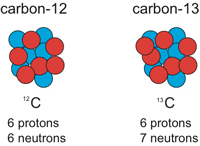
در مطلب قبل به بحث وزن اتمی و ایزوتوپ ها رسیدیم و چند سوال مطرح شد. حال برای این که آموخته های خود را بیازمایید، با چند سوال دیگر این بحث را شروع می کنیم و راجع به میانگین وزن اتمی بیش تر خواهیم آموخت. سوال 1: فرض کنید دانشمندان تصمیم می گیرند تا سیستم جدید وزن اتمی را طراحی کنند که در آن یک اتم 12C دیگر 12 amu وزن ندارد بلکه1.00 amu است. وزن یک اتم 16O در این سیستم چه قدر خواهد بود؟ جواب: 16/12 = 1.33 amu سوال 2: کربن موجود در طبیعت دارای 99% ایزوتوپ 12C و 1% ایزوتوپ 13C است. اگر 99 اتم 12C و یک اتم 13C داشتید، جرم 99 تا اتم 12C و 1 اتم 13C چه قدر خواهد بود؟ الف) 1188 amu و 13 amu ب) 99 amu و 1 amu ج) 1000 amu و 10 amu جواب: گزینه الف صحیح است. 99 اتم 12C دارای جرم 99 x 12.00 = 1188 amu خواهد بود و جرم یک اتم 13C خواهد بود: 1 x 13 = 13 amu سوال3: جرم میانگین 100 اتم موجود در سوال 2 را تعیین کنید. جرم کل این صد اتم : 1188 + 13 = 1201 amu میانگین جرم آن ها خواهد بود: 1201 amu/100 اتم = 12.01 amu ( برای هر اتم) اگر نگاه گذرا به جدول تناوبی داشته باشید، متوجه خواهید شد جرم اتمی کربن 12.01 نوشته شده است. همچنین توجه کنید که برای جرم اتمی، واحدی وجود ندارد. شما در جدول تناوبی متوسط جرم اتمی برای تعداد زیادی ایزوتوپ را مشاهده می کنید. سوال 4: جرم اتمی آرگون که دارای 3 ایزوتوپ طبیعی 38Ar, 36Ar و 40Ar است، چقدر است؟ درصد این ایزوتوپ ها در طبیعت به ترتیب 0.34%، 0.07% و99.58% است. راهنمایی: بدون استفاده از ماشین حساب می توانید جواب را پیدا کنید و بایستی از متوسط وزنی استفاده کنید. الف) 33.33 ب) 38.00 ج) 39.98 جواب الف اشتباه است. این گزینه، درصد متوسط را نشان می دهد: (0.34 + 0.07 + 99.58)/3 جواب ب نادرست است زیرا متوسط جرم های سه ایزوتوپ را در حالتی که وزن هر سه مساوی است، نشان می دهد. جواب ج صحیح است. می توانید از درصدهای کم ایزوتوپ هایی با عدد جرمی 36 و 38 این نکته را بفهمید. یعنی جرم باید به عدد 40 خیلی نزدیک باشد. در محاسبه، ایزوتوپ ها بایستی بر اساس درصدشان وزن شوند: 0.0034 x 36.00 + 0.0007 x 38.00 + 0.9958 x 40.00 = 39.98 34.97x + 36.95(1 - x) = 35.453 به ادامه مطلب که "رابطه جرم و مول" است، حتما مراجعه شود.شیمی دان نمونه 3
نظرات شما عزیزان:




 آمار
وب سایت:
آمار
وب سایت:







