
در شیمی از اصطلاح"مول" برای اندازه گیری مقدار یک عنصر یا ماده مرکب استفاده می شود. در واقع این یک تعریف و قسمتی از زبان بیان علم شیمی است. برای این که از مول بیش تر بدانیم، بهتر است از "وزن اتمی" شروع کنیم.
وزن اتمی:
شیمی دان ها همواره به دنبال کشف روابط وزنی بین عناصر بوده اند. بیایید تصور کنیم که در یک آزمایشگاه شیمی و در قرن 19 هستیم و می خواهیم بدانیم آزمایش بین روی و گوگرد به چه صورت انجام می شود:
 |
سوال 1:
وزن گوگرد ترکیب شده با روی (مقداری که واکنش داده است) چه قدر است؟
الف) 40 گرم ب) 8 گرم ج) 32 گرم
جواب الف اشتباه است؛ از آن جایی که مقداری از گوگرد بعد از اتمام واکنش هنوز هم باقی می ماند، تمام آن با روی واکنش نداده است.
جواب ب اشتباه است؛ دوباره وزن نهایی ماده مرکب را بررسی کنید و یادتان باشد که تمام مقدار روی مصرف شده است.
جواب ج صحیح است؛ زیرا در پایان واکنش هیچ اثری از روی نیست؛ تمام 65 گرم ا ز روی به طور شیمیایی مصرف شده است. ماده نهایی که شامل روی و گوگرد است، دارای وزن 97 گرم است؛ بنابراین 97 - 65 = 32 g از گوگرد مصرف شده است.
بنابراین در این واکنش، وزن ترکیبی روی و گوگرد 65 و 32 گرم است. اثر این وزن ترکیبی در دهه 1800 و در زمان دالتون مشخص شد، او فرض کرد که تمام ماده از اتم ها تشکیل شده است و واکنش ها شامل ترکیبات این اتم ها با نسبت های صحیح (غیر کسری) هستند.
هم چنین دالتون فرض کرد تمام اتم های یک عنصر دارای جرم یکسانی هستند (اکنون ما می دانیم که این فرض اشتباه است).
ما می دانیم که یک اتم گوگرد با یک اتم روی ترکیب می شود تا ماده مرکب سولفید روی را حاصل کند، اگر 32 گرم از گوگرد با 65 گرم از روی واکنش دهد، یک اتم روی، 65/32 بار سنگین تر از یک اتم گوگرد است. معادله پایین این واکنش را نشان می دهد:
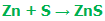
در این معادله، نمادهای عناصر در شکل عنصری آن ها نوشته شده است و ماده مرکب ZnS نشان می دهد که نسبت یک به یک از اتم های روی و گوگرد وجود دارد.
سوال 2:
اگر اتم روی با دو اتم گوگرد ترکیب شود، واکنش آن به کدام صورت خواهد بود؟
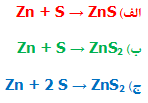
جواب ج صحیح است؛ زیرا ماده مرکب سمت راست به خوبی نسبت یک به دو از روی و گوگرد را بیان می کند. هم چنین این ماده مرکب به ما می گوید که دو اتم گوگرد در سمت راست معادله به دو اتم گوگرد در سمت چپ نیز نیاز دارد.
سوال3:
با فرض این که وزن یکسانی از هر عنصر (65 گرم روی و 32 گرم از گوگرد) در واکنش با هم مصرف شده اند و یک اتم روی با دو اتم گوگرد واکنش داده است، وزن ترکیبی گوگرد چه قدر خواهد بود؟
الف) 16 گرم ب) 64 گرم ج) 32 گرم
گزینه الف صحیح است. اکنون 32 گرم از گوگرد نشان دهنده واکنش دو اتم گوگرد با یک اتم روی است. در نتیجه هر اتم گوگرد باید وزن نصف شده داشته باشد یعنی 16 گرم.
مرکز یادگیری سایت تبیان - تنظیم: آلچالانلو
نظرات شما عزیزان:




 آمار
وب سایت:
آمار
وب سایت:







